共鳴構造式
・→は電子2個(-=・・)の移動を表す。・共鳴とは、配電子(ローンペア)が移動すること。
例1.CH3NO2(ニトロメタン)
例2.CH3CO2-(酢酸イオン)
例3. アニソール(メトキシベンゼン)
例4.ニトロベンゼン
電子の移動について、詳しくは次の電子効果で述べる。
電子効果・・・I,M(R),H
1.I効果(inductive effect =誘起効果)
・必ずσ結合(単結合)で起きる。
・有機反応を考えるときは、電荷分離した形で考えること!!
(1)-I効果(電子吸(求)引誘起効果)
電気陰性度が大きい原子の側に結合に使われているσ電子が引き寄せられる効果。
〔例1〕 δ+ δ- 〔例2〕 δ+ δ-
CH3CH2→Cl H3C→O―H
MEMO:電気陰性度←重要!!
F > O > N ≧ Cl > C > H > Met
(4.0) (3.5) (3.0) (3.0) (2.5) (2.1) Li(1.0)
Br(2.8) Mg(1.2)
Na(0.9)
Zn(1.7)
〔反応例〕
(2)+I効果(電子供与性誘起効果)
電気陰性度が小さい原子の側に結合に使われているσ電子が引き寄せられる効果。
〔例1〕 δ- δ+ - +
CH3Li = H3C←Li = :CH3 Li
(メチルリチウム)
〔有機リチウム試薬〕 分極した形 電荷分離した形
〔例2〕 δ- δ+ - +
CH3MgBr = H3C←MgBr = :CH3 MgBr
(メチルマグネシウムブロミド)分極した形 電荷分離した形
〔有機マグネシウム試薬〕
(Grinard試薬)
2.M効果(mesomeric effect=共鳴効果)←超重要!!!
〔M効果はR効果(resonance effect)とも言う〕
・必ずπ結合(二重結合、三重結合)で起きる。
・共鳴とはπ電子(またはローンペア)が移動すること。
(1)-M効果(電子求引性共鳴効果)
〔例1〕カルボニルノ立ち上がり
〔例3〕ニトリルの立ち上がり
〔反応例〕
慣れてきたら
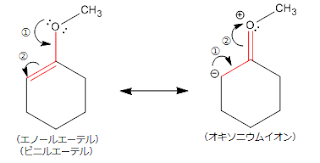
(2)+M効果(電子供与性共鳴効果)
[基本形]
※X=N,O,Sなどの非共有電子対(孤立電子対、ローンペア)を持つ原子
・①のローンペアの動きが+M効果。
・②で動いているのはπ電子(π結合)。
・π電子(π結合)がないと+M効果は起こらない。
[例1]
[例2]
[例3]
[反応例]…ベンジルアルコールのTHP化反応(水酸基の保護)
(tetrahydropyran:テトラヒドロピラン)
<反応機構
一口メモ
(3)ケト/エノール互変異性(M効果による)
[エノール形よりケト形の方が安定な理由]
・結合エネルギーの差による。
・単純に結合(解離)エネルギーを計算すると、ケト形は1489KJ/molでエノール型は 1398KJ/mol となり、ケト形の方がより強く結合している。
[類似例]
Check:共鳴構造とは、原子配列は同じで、電子の存在位置が違う構造のこと。
(4)共役と共鳴
共役…多重結合が単結合でつながっているもの。
共鳴…電子やローンペアの移動。
〔例1〕
〔例2〕
☆〔例1〕の立体電子図
・2重結合を見たらp軌道のπ電子を立体的にイメージすること!!←後も意識してしくべし!!!!!
(5)H効果(hyperconjugation effect,超共役)
・C-H結合のσ電子対が空の2p軌道(または、2重結合)に部分的に(わずかに)流れこむことによって起こる、電子の非局在化(安定化)効果。
〔例1〕(カルボカチオンの安定性)
<<カルボカチオンが安定な理由>>
☆3つのH効果と3つの+I効果を受けている。
⇒☆正電荷(陽電子、カチオン)の非局在化
⇒ ☆安定
〔反応例1〕
☆二重結合にH+(プロトン)がたかるイメージ図
〔Markovnikov則〕
・非対称オレフィン(アルケン)にHX(ハロゲン化水素)が付加する場合、HはHの多い炭素につ く。
〔例2〕(ブテンの熱力学安定性)
<<多置換アルケンが安定な理由:H効果による>>
・σC-H軌道のπ電子が二重結合(π結合)の電子に部分的に流れ込む(オーバーラップする)。
⇒H効果
☆2つのH効果による電子の非局在化が安定化効果につながる。
〔反応例2〕
〔Saytzeff則〕
・アルケン(オレフィン)を与える脱離反応の場合、HはHの少ないほうの炭素からとれる。
☆Saytzeff則の例外をHofmann則と言う。
〔Hofmann則〕
・速度論支配の反応条件により、置換基の少ないアルケンを生成する。
〔反応例〕
〔反応機構〕
共役不飽和系
1.アリルカチオン
・アリル基とは:
メモ
・”アリル”と”アリール”を区別すること
・”アリール”は芳香族化合物の基を意味する
・英語で”アリール”は”allyl","アリール"は”aryl”と記す
〔例1〕アリルアルコール
〔例2〕臭化アリル(アリルブロミド)
(1)アリルカチオンの安定性(⇒共鳴により安定化を受ける)
・アリルカチオンは共鳴により安定化される(共鳴安定化効果)
2.1,3‐ブタジエン
(1)1,3-ブタジエンの結合距離
☆1,3-ブタジエン立体電子構造
(2)1,3-ブタジエンの立体配座
・sはsingle bond(単結合、一重結合)のsです。
(3)1,3-ブタジエンとハロゲン化水素(HX)の反応
〔反応例1〕
〔参考例〕
<<反応機構>>
(4)1,3-ブタジエンとHBrの反応
速度論支配(kinetic control)と熱力学支配(thermodynamic control)。
〔反応例〕
A.速度論支配の反応…反応のしやすさ(=反応速度)で決まる。
B.熱力学支配の反応…生成物の熱力学的安定性で決まる。
↑Bの場合、下記の平衡が存在する。
Diels‐Alder反応
<<基本形>>
①1,3-ブタジエンはs-cis配座で反応する。
②〔4+2〕π付加環化反応とも呼ばれている。(代表的なペリ環状反応の一つである)
③アルケン(ジエノフィル)の立体は保持される。(立体特異的な反応であり、syn付加で起こる)
④endo則
<③の立体特異的な反応例>
<④の立体特異的な反応例>
(1)endo-付加体が生成する場合

(2)exo-付加体が生成する場合
※・"endo"は英語で『内側』の意味
・"exo"は英語で『外側』の意味
芳香族化合物
1.ベンゼン誘導体の命名法
(1)一置換ベンゼン
分類…①~ベンゼン ②慣用名
〔①の例〕
〔②の例〕←暗記!!!
(2)二置換ベンゼン
・数字(位置番号)またはortho(オルト),meta(メタ),para(パラ)(省略形:o-,m-,p-)を用いる。
〔例1〕
〔例2〕
〔例3〕
<<官能基の優先順位>>重要!!!
(アンモニウム)>カルボン酸>エステル>アミド>ニトリル(シアン)>アルデヒド>ケトン
(∼oic acid) (∼ate) (∼amide) (∼nitrile) (∼al) (∼one)
>アルコール>アミン>エーテル
(∼ol) (∼amine) (∼ether)
※(ハロゲン、ニトロは主たる基にはならない)
☆アン タに か えす 網戸 は 2戸 ある けど ヒド い アミ になって ぇる
(3)三置換ベンゼン
・数字(位置番号)を用いる。・・・小さい数字を優先させる。
〔例1〕
〔例2〕
(4)ベンゼン環が置換基の場合
2.ベンゼンの反応
・ベンゼンは通常アルケン(オレフィン)とは異なり、反応性が低い➡共鳴安定化を受けているから。
3.ベンゼンのKekule´構造
<<.ベンゼンのKekule´構造式>>
<<ベンゼンの立体電子構造>>
◇ベンゼンはこのような構造をしているが、1,3,5-シクロヘキサトリエン(二重結合が3つ、単結合が3つ)ではなく、すべてが1.5重結合と考えたほうがいい。
メモ:<<芳香族性の条件>>
(1)平面環状構造を有していること。(構成原子がsp2混成軌道をとる)
(2)4n+2個のπ電子を持つこと(Heuckel則)(n=0を含む整数)
4.ベンゼンの安定性
ベンゼンの水素化における発熱反応では、計算値上ΔH°= -360kJ/mol の熱量が必要だが、実測値はΔH°= -208kJ/mol である。この差の-152kJ/molは共鳴エネルギー(非局在化エネルギー、安定化エネルギー)に由来するものであり、ベンゼンは152kJ/molもの”余分な安定性”を持っていると言える。
5.芳香族性(Heuckel則)
Heuckel(ヒュッケル)則・・・芳香族性を持つ条件
①環状の平面構造の分子であること。
②4n+2個のπ電子を持つこと。(n=0を含む整数)
③環を構成しているすべての原子がp軌道を持つこと。
↑①~③=環の中でπ電子またはローンペアがクルクル廻るもの➡電子の非局在化➡安定
※例外あり()
(1)6員環:二重結合3個(電子6個)=6πなら芳香族
〔例.芳香族性のあるもの〕
〔例.芳香族性の無いもの〕
(2)5員環:二重結合2個(電子4個)+ローンペア(p軌道上に2個)=6πなら芳香族
〔例.芳香族性あるもの〕
〔例.芳香族性の無いもの〕
(3)7員環:二重結合3個(電子6個)+ローンペア(p軌道上に2個)=8πで芳香族性無し(反芳香族)
:二重結合3個(電子6個)+ローンペア(p軌道上に0個)=6πで芳香族性あり
〔例.芳香族性のあるもの〕
〔例.芳香族性の無いもの〕
(4)その他
〔例.芳香族性のあるもの〕
〔例.芳香族性の無いもの〕
(5)アヌレン
・二重結合と単結合を交互に持っている単環状化合物のこと。
〔例.芳香族性のあるもの〕
〔例.芳香族性の無いもの〕
↑10π系だが、いずれも平面構造をとれないため。
↑4n個のπ電子をもつ平面共役分子は反芳香族である。
6.芳香族、非芳香族、反芳香族化合物
◆鎖状共役系化合物を環状化合物とした場合、
・π電子エネルギーが 減少する→芳香族
・π電子エネルギーが 増大する→反芳香族
・π電子エネルギーが 変わらない→非芳香族
〔例1〕
〔例2〕
〔例3〕
〔例4〕
7.その他の芳香族化合物
(1)ベンゼノイド(=ベンゼン系)芳香族化合物
・ベンゼン環が縮環している。
(2)非ベンゼン系芳香族化合物
・ベンゼン環を含まない芳香族化合物
[代表例]
(3)フラーレン
・C60のサッカーボールの芳香族化合物
・12個の5員環と20個の6員環からなっている。(90本の単結合と30本の二重結合からなっている)
芳香族化合物の反応
1.芳香族求電子置換反応
基本形
<<反応機構>>
<<σ錯体のイメージ>>
メモ:アレーン(arene)=芳香族炭化水素(CnHm)
アレン(allene)=3個の炭素の間に2個の二重結合が連続した C=C=C の部分構造を持つ不 飽和化合物の総称
<<おすすめの反応機構>>
(1)ベンゼンのニトロ化
<<反応機構>>
(2)ベンゼンのハロゲン化
(3)ベンゼンのスルホン化
<<反応機構>>
――本反応は可逆反応である――
(4)Friedel Craftsアルキル化
<<反応機構>>
――副生成物の場合――
(5)Friedel Craftsアシル化
<<反応機構>>
(6)Friedel Crafts反応の問題点
①ハロゲン化されたアルキルとAlCl3から生成するカルボカチオンが、より安定なカルボカチオンに転位するため、主生成物はより安定なカルボカチオンに由来するものである。
②ベンゼン上に電子吸引性基がある場合、Friedel Crafts反応は起こらない。
(ベンゼン上の電子密度が低下するため)
③ベンゼン環上にアニオンまたはローンペアを有する基(電子供与性基)がある場合、Friedel Crafts反応は起こらない。
(アニオンまたはローンペアとAlCl3が複合体(錯体)(complex)を形成し、その結果、ベンゼン環上の電子密度が低下するため)
④多置換アルキル化が起こる。
(原料のベンゼンよりもモノアルキル化体の方がベンゼン環上の電子密度が高いため)
(7)Friedel Craftsアシル化反応の合成化学的応用:Clemmensen還元
①Friedel Craftsアルキル化
②Friedel Craftsアシル化+Clemmensen還元
③α‐テトラロンの合成(Clemmensen還元以外の反応機構は各自で考えること)
(8)オルト/パラ配向性の基(活性化基)
・電子供与基(主に、ローンペアをもっている基、アルキル基、フェニル基など)
〔前述の共鳴構造式の例3参照〕
注意:ハロゲンは不活性化基。配向性を考える時は電子供与性基
・ブロモベンゼンの反応性はベンゼンよりも低い。
(9)メタ配向性の基(不活性化基)
・電子吸引性基(主に、-M効果および+I効果を持っている基)
〔前述の共鳴構造式の例4参照〕
ニトロ基は最強の不活性化基。-CONHRまでの強い不活性化基は-M効果による、それ以下の不活性化基は-I効果による電子吸引性を示す。




























































































0 件のコメント:
コメントを投稿